Tema 3. 3º ESO. CLASIFICACIÓN DE LA MATERIA.
SISTEMAS MATERIALES.
CONTENIDOS.
Sistemas materiales homogéneos y heterogéneos.
Sustancias puras y mezclas. Propiedades características de las sustancias puras.
Elementos y compuestos
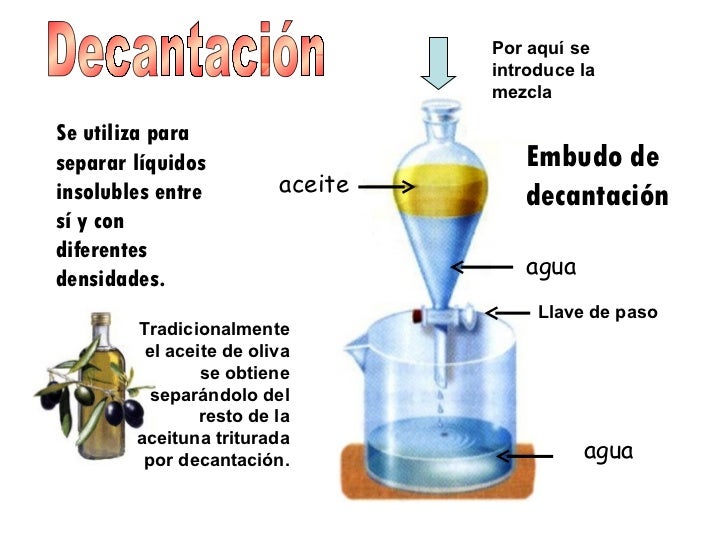
Métodos de separación de mezclas heterogéneas: tamizado o cribado, filtración, sedimentación, decantación, separación magnética.
Disolución. Clases de disoluciones: según el estado físico; según la concentración (diluida, concentrada, saturada.)
Métodos para separar los componentes de una disolución. Cristalización, destilación, cromatografía, extracción.
Formas de expresar la concentración de una disolución. % en masa, % en volumen; concentración en masa
(g/litro) .
Solubilidad. Definición. Solubilidad de un gas en un líquido; variación con la T.
EJERCICIOS. TEMA 3. Sistemas Materiales. Disoluciones.
De las siguientes sustancias, indica si son mezclas heterogéneas (HE) ó mezclas homogéneas(HO).
Cocido. HE Vinagre. HE Licor. HE Zumo de naranja. HO
Aire. HO Agua mineral. HE Agua azucarada. HE
roca de granito___ Lejía. HO Ensalada. HE
Completa y memoriza.- El aire es una mezcla de sustancias gaseosas, formado aproximadamente por:
El 78 % de nitrógeno.
El 21 % de oxígeno.
El 1 % restante de otras sustancias. (como el argón, vapor de agua , anhídrido carbónico ,ozono, dióxido de carbono, hidrógeno y gases nobles (criptón y argón)
Indica si las siguientes sustancias son elementos (E), compuestos(C) o disoluciones(D).
Agua de mar.___ Agua destilada.___ Leche___
Cal viva (oxido de calcio)___ Azufre___ sal común___
Aire___ Grafito (Carbono) ____ Gas neón___.
Cloro____ Hierro____ Acero____
Diamante (Carbono)___
Completa la siguiente tabla:
Técnica de separación de mezclas heterogéneas. Para qué sirve y propiedad en que se basa.
Filtración. Sirve para recuperar un solido que se encuentra en el interior de un liquido.
Flotación Sirve para separar especies minerales mediante la adhesión selectiva de partículas minerales a burbujas de aire.
Decantación Sirve para separar los componentes de un liquido in miscible.
Separación magnética. Sirve para separar dos sólidos mediante un imán que atraiga al compuesto ferroso y lo separe del compuesto no ferroso.
El agua mineral es una disolución de varias sustancias. Casi el 100% es __________________ pero también tiene sustancias disueltas como por ejemplo___ __ __ ____ ___ ___ ___ ___ __ _____.
Te puede ayudar si miras la etiqueta de un botella de agua mineral
El agua de mar es una ______________________.
Las dos sustancias más abundantes en el agua de mar son: _____ ____ ___ ____ y ____ __ ___ ___ _.
Explica porqué el grafito y el diamante son elementos.
Porque
¿El hierro es un elemento?.Si.
El acero ¿es un elemento?.No.
La sal común (o sal de cocina) es un compuesto químico llamado cloruro sódico.
El agua destilada (agua) es un compuesto químico que tiene de fórmula: H2O.
Explica qué es una disolución. Si ésta tiene dos componentes ¿qué es el disolvente y qué es el soluto?
Es es una mezcla homogénea a nivel molecular o ionico de dos o mas sustancias que no reaccionan entre si , cuyos componentes se encuentran en proporciones variables.
El disolvente esta formado por una fase que se dispersa llamada soluto y otra dispersante llamado disolvente que generalmente se encuentra en mayor proporcion que el soluto.
El soluto es el compuesto de menor proporción al solvente.
¿.Podríamos decir que una mezcla de agua y arena es una disolución? ¿Por que?
¿Qué es la concentración de una disolución?.
Es la magnitud química que expresa la cantidad de un soluto que hay en una cantidad de disolución.
Explica las diferencias entre disolución diluida, concentrada y saturada. Pon un ejemplo de cada una de ellas.
Disolución Diluida = Es aquella en donde la cantidad de soluto que interviene esta en mínima proporción en un volumen determinado.
Ejemplo => 0,1gr NaCl en 100 ml de agua
Disolución Concentrada = Tiene una cantidad de soluto en un volumen determinado.
Ejemplo => 28gr de NaCl en 100ml de agua
Disolución Saturada =Tiene la mayor cantidad posible de soluto para una temperatura y presión dadas.
Ejemplo => Solucion de cloruro de sodio
Clasifica en diluidas o concentradas las siguientes disoluciones: 2 g de lejía en 5 litros de agua, 30 gramos de sal en 4 litros de agua, 0’8 kg azúcar en 1600 ml de agua.
Diluidas = 2 g de lejía en 5 litros de agua, 0’8 kg azúcar en 1600 ml de agua.
Concentradas = 30 gramos de sal en 4 litros de agua.
Si en una botella de cerveza indica 5,5º ¿Qué quiere decir?
Que 5´5º es la gradiacion alcohólica del etanol.
Identifica tres elementos y tres compuestos que manejes en tu vida diaria.
Elementos = Plátano, Cereza y Manzana.
Compuestos = Gel, Agua y Hierro.
¿En qué consiste la decantación, la cristalización y la destilación?.
La decantacion separa un solido o liquido mas denso de otro fluido menos denso que ocupa la parte superior de la mezcla.
La cristalización separa dos o mas sustancias liquidas con puntos de ebullición distintos entre si.
La descilacion separa distintas sustancias que componen una mezcla liquida mediante
vaporización y condensación.
La concentración del agua de mar es 28’5 g/L ¿cuánta sal podemos obtener con 10 litros de esa agua de mar?.
Sal = 28´5/10 x 100 = 285 g
Preparamos una disolución que contiene 24 g de cloruro de sodio disueltos en 550 g de agua. Halla el porcentaje en masa de soluto en la disolución obtenida.
Scl = 24g/24g+550 x 100 = 4´18%
¿Por qué se disuelve mejor el cacao en leche caliente que fría?.
Porque el cacao contiene gran cantidad de grasas vegetales que se disuelven mas fácilmente con el calor.
Echamos en un vaso 200 mililitros de agua y 30 de azúcar. La disolución ocupa un volumen de 222 ml. Completa los datos de la tabla:
Nombre Masa (g) Masa (Kg) Volumen (mL) Volumen (L)
Soluto
Disolvente
Disolución
En esa disolución, calcula:
1) concentración en % en masa.
2) concentración en g/L.
La concentración de una disolución de agua y sal es de 20 g/l. El volumen total de la disolución es de 4000 ml. Halla la masa de sal que se ha disuelto. Sol. 80 g
Elabora el esquema de un proceso de separación para las siguientes mezclas:
a) agua y alcohol.
b) aceite y agua.
c) Limaduras de hierro y arena
d) arena y azúcar
¿Verdadero o falso F?.
La cromatografía de la tinta permite conocer los componentes de la tinta. V
La destilación permite separar dos líquidos que tienen puntos de fusión muy parecidos. F
Disolvemos azúcar en agua. Cuando añado un poco más de azúcar observo que no se disuelve y se deposita en el fondo del vaso. ¿Cómo podemos explicar este fenómeno? ¿Qué nombre reciben este tipo de disoluciones?
Disolución diluida.
Tenemos 25 g de una disolución de sal en agua al 20 % en masa; se evapora el agua ¿qué cantidad de sal queda?.
20%/25g x 100: 80g
Una disolución al 12 % de ácido sulfúrico indica que en 100 gramos de disolución hay ...
Para obtener 50 ml de alcohol puro ¿qué cantidad de licor de 40º hará falta?.
Hemos disuelto 3750 mg de sal en agua. El volumen total de la disolución es de 75 ml. Halla la concentración de la disolución expresada en g/l. Sol: 15 g/l
Se mezclan 80 g de azúcar con 0,5 kg de agua. Hallar:
La masa de la disolución.
La concentración de la disolución expresada en % en masa. Solución. a) 580 g b) 13.8 %
Si representamos los átomos de diferentes elementos de la siguiente forma:
N H Cl O He
Imagina que tenemos varios recipientes con sustancias gaseosas. Si pudiéramos ver los átomos y moléculas e hiciéramos una fotografía y obtuviéramos algo parecido a las siguientes viñetas:
Clasifica las sustancias de los recipientes anteriores en mezclas o en sustancias puras.
Mezclas: C, D, F
Sustancias Puras: A, B, E
¿Sabrías escribir la fórmula y el nombre de las sustancias de los recipientes anteriores?
No
Nombra adecuadamente cada uno de los sistemas anteriores. Recipiente A: tiene una sustancia pura que es el agua; el B: tiene una sustancia pura que es el nitrógeno....
Dibuja el aspecto que tendría un recipiente con agua y oxígeno disuelto en ella.
Páginas
- Página principal
- Fisica y Quimica 4º Ejercicios de Examen (Ev1)
- Fisica y Quimica 4º Ejercicios de Examen (Ev2)
- Fisica y Quimica 4º Ejercicios de Examen (Ev2) Par...
- Fisica y Quimica 4º Ejercicios de Examen (Ev3)
- Ejercicios del Examen de Pendientes de 3º (Tema 1)...
- Ejercicios del Examen de Pendientes de 3º (Tema 2)...
- Ejercicios del Examen de Pendientes de 3º (Tema 3)...
- Ejercicios del Examen de Pendientes de 3º (Tema 4)...
- Ejercicios del Examen de Pendientes de 3º (Tema 5)...
- Ejercicios del Examen de Pendientes de 3º (Tema 6)...
- La Marinera (Baile Tradicional de Perú)
- TIC 1º Bachillerato
- LA CONDICIÓN FÍSICA





No hay comentarios:
Publicar un comentario